Affichages
Sommaire |
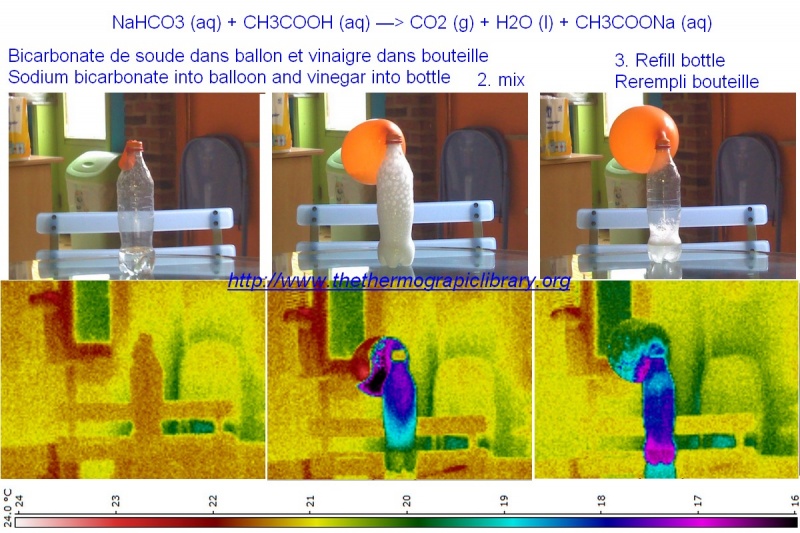
Thermographie de la réaction chimique vinaigre et bicarbonate de soude
Réaction chimique
Cette expérience est un classique de la chimie, elle permet de mettre en évidence une réaction chimique, forte, endothermique et productrice de mousse ainsi que de C02.
Cependant, en visualisant cette réaction chimique dans des bouteilles en PET et avec un ballon en latex, on observe un comportement nettement moins simple que les équations.
En effet, d'une part la réaction aqueuse et mousseuse principale est bel et bien endothermique mais en revanche l'émission de CO2 est fortement exothermique.
Or la caméra thermique, dans ce cas-ci, ne verra en plus qu'une partie de la réaction exothermique dans le ballon car tant le latex que les gaz son perméables aux infrarouges dans la longueur d'onde ici utilisée.

En addition, une vidéo thermique de la réaction chimique: You Tube
Et à volume constant?
Observons à nouveau que la base aqueuse refroidit, la phase mousseuse devient froide également mais que la phase gazeuse est plus chaude.
La seconde partie de l'image est prise après le percement du bouchon et échappement du gaz sous pression.
Plus en détail:
Utilisation du CO2 en comparaison d'avec l'air
À propos, est-ce que le CO2 absorbe plus les radiations infrarouges de l'air? Voici une expérience avec un petit brûle-parfum:
Il semblerait bien que oui si l'on visualise ce thermogramme (attention, l'air utilisé n'est pas pur ni totalement sec et le C02 utilisé contient encore des traces de bicarbonate de soude en poudre donc il s'agit d'une démonstration).
Il reste cependant à comprendre si la réaction massivement exothermique du ballon est en partie due à une pollution manuelle ou à un effet mécanique de dilatation cependant la surface de latex et le gaz contenu étant massivement transparents aux infrarouges, il est peu probablement que cela ne soit pas réellement exothermique. Ce dioxyde de carbone étant plus lourd que l'air c'est également une situation logique.