Affichages
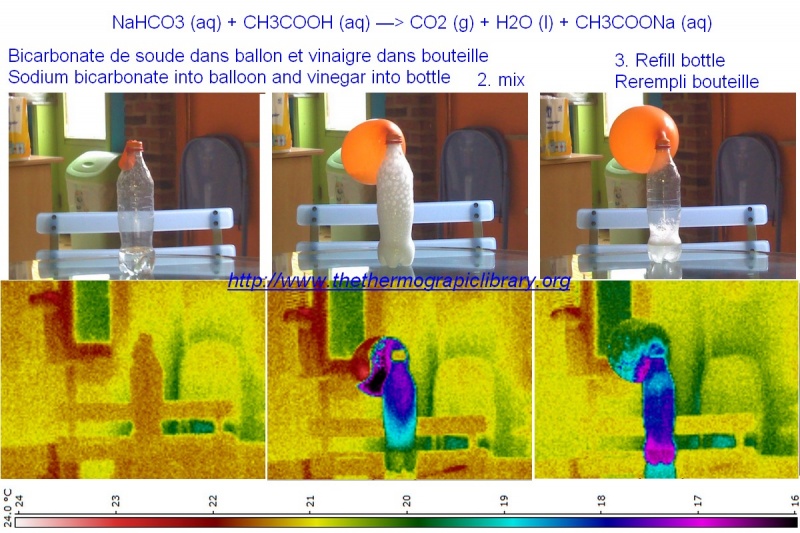
Thermographie de la réaction chimique vinaigre et bicarbonate de soude
Cette expérience est un classique de la chimie, elle permet de mettre en évidence une réaction chimique, forte, endothermique et productrice de mousse ainsi que de C02.
Cependant, en visualisant cette réaction chimique dans des bouteilles en PET et avec un ballon en latex, on observe un comportement nettement moins simple que les équations.
En effet, d'une part la réaction aqueuse et mousseuse principale est bel et bien endothermique mais en revanche l'émission de CO2 est fortement exothermique.
Or la caméra thermique, dans ce cas-ci, ne verra en plus qu'une partie de la réaction exothermique dans le ballon car tant le latex que les gaz son perméables aux infrarouges.
Cependant, cette expérience permet également de regarder si l'air est plus ou moins perméable aux infrarouges que le CO2 et sur ce plan-là, malgré un ballon de plus petit taille, l'amortissement du rayonnement thermique est largement supérieur en ce qui concerne le dioxyde de carbone. Ce qui signifie qu'un rayonnement thermique traversant du C02 est largement plus absorbé que si il s'agissait d'air.
Oui, mais le ballon est plus petit donc l'enveloppe est plus épaisse que pour l'exemple de l'air. Soit gonflons un ballon de la même manière, voici le résultat comparé:
En addition, une vidéo thermique de la réaction chimique: